4.1.- Maquinas Térmicas y Refrigeradores
Un refrigerador es un dispositivo cuyo objetivo
es extraer calor de un cuerpo a una cierta temperatura y cederlo a otro que se
encuentra a una temperatura superior. Para ello utiliza de una sustancia de
trabajo (vapor de agua, aire u otras sustancias) que realiza una serie de transformaciones
termodinámicas de forma cíclica, para que pueda funcionar de forma
continua, como sucede con las máquinas térmicas.
Como ya se ha comentado en la introducción el
paso de calor de un cuerpo frió a otro caliente no se produce de forma
espontánea. Se llega así a un nuevo enunciado del Segundo Principio:
Se puede representar un refrigerador de forma esquemática de la siguiente manera:

Absorbe una cantidad de calor Q2 de un foco frío a una
temperatura T2
Consume una cantidad de trabajo W
Cede una cantidad de calor Q1 a un foco caliente a una
temperatura T1
Como se ha comentado anteriormente, un refrigerador trabaja
en ciclos, por lo que la variación de energía
interna es nula. Teniendo en cuenta el criterio de signos, el calor
cedido al foco caliente será:


En este caso, la potencia es evidentemente una potencia consumida.
Eficiencia (ε)
Un refrigerador se optimizará reduciendo el trabajo
consumido para la misma cantidad de calor extraída del foco frío. La eficiencia
(ε) de un refrigerador se define entonces como:

La limitación impuesta por el enunciado de Clausius nos
indica simplemente que la eficiencia debe ser menor que infinito, ya que el
trabajo debe ser distinto de cero.

4.2.- Enunciado de la segunda ley de la termodinámica
Enunciado de Clausius:
Resulta deseable construir un refrigerador que pueda
realizar su proceso con el mínimo de trabajo. Si se pudiera construir uno donde
el proceso de refrigeración se realice sin ningún trabajo, se tendría un
refrigerador perfecto. Esto es imposible, porque se violaría la segunda ley de
la termodinámica, que es el enunciado de Clausius de la segunda ley (Rudolf
Clausius, alemán 1822-1888):
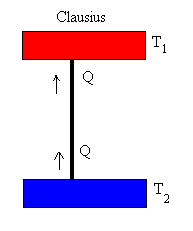
“Es imposible construir una máquina cíclica, que no tenga otro efecto que transferir calor continuamente de un cuerpo hacia otro, que se encuentre a una temperatura más elevada”.
En términos sencillos, el calor no puede fluir
espontáneamente de un objeto frío a otro cálido. Este enunciado de la segunda
ley establece la dirección del flujo de calor entre dos objetos a diferentes
temperaturas. El calor sólo fluirá del cuerpo más frío al más cálido si se hace
trabajo sobre el sistema.
4.3.- Entropía, procesos reversibles e irreversibles
Volviendo al ejemplo anterior de la caja con separaciones y
canicas, vamos a explicar qué es un proceso reversible y qué un proceso no
reversible. Llamamos proceso “reversible” al que se puede invertir y dejar a
nuestro sistema en las mismas condiciones iniciales. Teniendo en cuenta nuestra
caja ya sin las separaciones, tenemos a las canicas revueltas unas con otras,
es decir, sin un orden. Si el proceso que efectuamos de quitar las divisiones
fuera reversible, las canicas tendrían que ordenarse espontáneamente en azules,
amarillas y rojas, según el orden de las divisiones. Esto, evidentemente, no
ocurrirá.
4.4.- ciclo de carnot
Se define ciclo de Carnot como un proceso
cíclico reversible que utiliza un gas perfecto, y que consta de dos
transformaciones isotérmicas y dos adiabáticas, tal como se muestra en la figura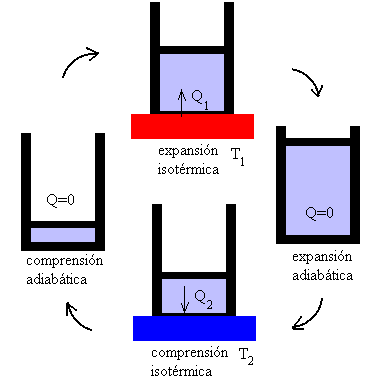 En cualquier ciclo, tenemos que obtener a partir de los
datos iniciales:
En cualquier ciclo, tenemos que obtener a partir de los
datos iniciales: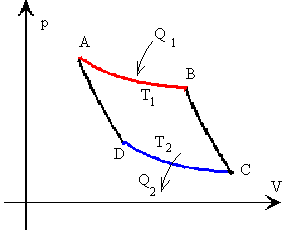 4.5.- Entropia
4.5.- Entropia
Etimológicamente “entropía” , asociada a la termodinámica,
surgió como palabra acuñada del griego, de em (en: en, sobre, cerca
de...) y sqopg (tropêe: mudanza, giro, alternativa, cambio,
evolución).
 4.6.- Exergia
4.6.- Exergia
La exergía es una propiedad termodinámica que
permite determinar el potencial de trabajo útil de una determinada
cantidad de energía que se puede alcanzar por la interacción espontánea entre
un sistema y su entorno. Informa de la utilidad potencial del sistema como
fuente de trabajo. Es una propiedad termodinámica, por lo que es una magnitud
cuya variación solo depende de los estados inicial y final del proceso y no de
los detalles del mismo.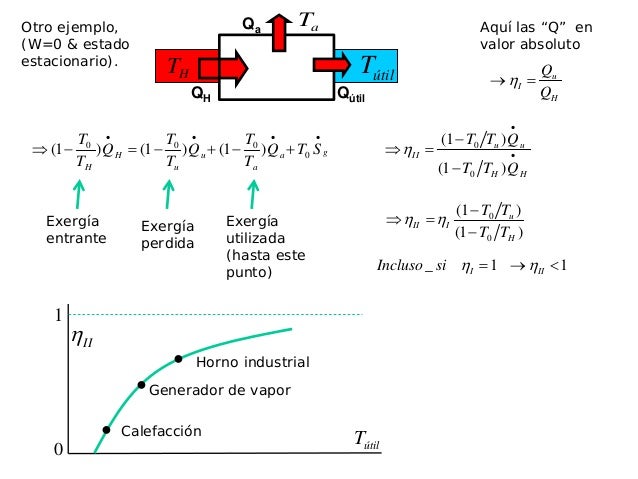 4.7.- Trabajo Reversible
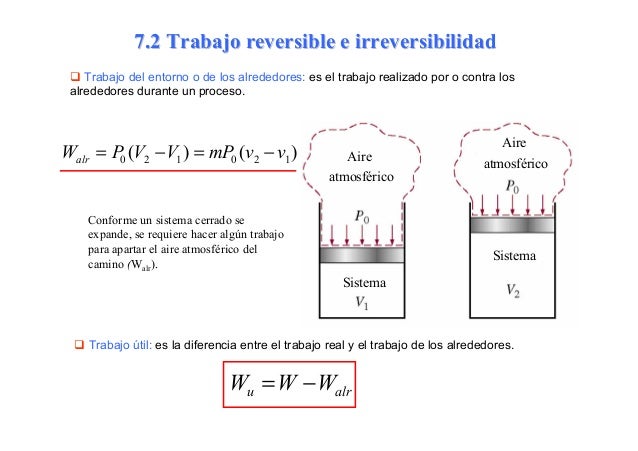
4.7.- Trabajo Reversible
Trabajo reversible:
 4.8.- Balance de exergia en sistemas abiertos
4.8.- Balance de exergia en sistemas abiertos
a mayor parte de los procesos industriales tienen
lugar en sistemas abiertos. Cuando se lleva a cabo un proceso semicontinuo o
continuo se denomina un sistema abierto. En un sistema abierto es posible
la transferencia de masa y de energía a través de sus límites; la masa
contenida en él no es necesariamente constante. Una pared también puede ser
semipermeable, si permite el paso sólo de algunas sustancias. Propiedades específicas: Son cantidades intensivas que
son obtenidas a partir de la división de una propiedad extensiva entre la
cantidad total del material del proceso, por ejemplo si el volumen de una
sustancia es 300 cm3 y la masa es de 300 g, su volumen específico es de 1
cm3/g; si la velocidad del flujo másico es de 100 Kg/min y la de flujo
volumétrico es 150 l/min, el volumen específico del material será de (150
l/Min)/(100 Kg/Min)= 1.5 l/Kg. La energía cinética específica es,
la energía cinética de la corriente, 300 J/min, sobre el flujo másico, Ec’=
(300 J/min)/(100 Kg/min)=3 J/Kg
Propiedades específicas: Son cantidades intensivas que
son obtenidas a partir de la división de una propiedad extensiva entre la
cantidad total del material del proceso, por ejemplo si el volumen de una
sustancia es 300 cm3 y la masa es de 300 g, su volumen específico es de 1
cm3/g; si la velocidad del flujo másico es de 100 Kg/min y la de flujo
volumétrico es 150 l/min, el volumen específico del material será de (150
l/Min)/(100 Kg/Min)= 1.5 l/Kg. La energía cinética específica es,
la energía cinética de la corriente, 300 J/min, sobre el flujo másico, Ec’=
(300 J/min)/(100 Kg/min)=3 J/Kg
4.9.- Balance de exergia en sistemas cerrados
La exergía es una propiedad termodinámica que permite
determinar el potencial de trabajo útil de una determinada cantidad de energía
que se puede alcanzar por la interacción espontánea entre un sistema y su
entorno. Informa de la utilidad potencial del sistema como fuente de trabajo.
Siendo que es una propiedad,hay que tener en cuenta que el valor de una
propiedad no cambia a menos que cambie el estado de la materia, es decir el
valor se mantiene siempre y cuando se mida en el mismo estado
independientemente de la temperatura o la presion a la que se encuentre.
Definida de otra forma la exergía es la porción de la
energía que puede ser transformada en trabajo mecánico, la parte restante, sin
utilidad practica, recibe el nombre de anergía o entropía.
.png)

4.4.- ciclo de carnot






Me ha sido muy útil tu artículo, muy bien explicado. Tengo el blog de Todo Pipetas y me es de gran ayuda entender este tipo de cosas de manera fácil.
ResponderEliminar